Das Vorhaben endete am 31.12.2014.
Abschlussbericht – Zeitstrukturen endokriner Systeme
Mit dem Schwerpunkt: Zum Einfluss von Indolaminen auf Sekretionsrhythmik und Signaltransduktionsprozesse der Langerhansschen Insel
Vorhabenbezogene Kommission
Vorsitzender: OM Prof. em. Dr. med. habil., Dr. h.c. Gottfried Geiler
Mitglied: OM Prof. em. Dr. med. habil. Renate Hanitzsch
Mitglied: KM Prof. em. Dr. med. habil., Dr. h.c. Lutz Vollrath
Projektgruppe
Projektleiter: OM Prof. em. Dr. med. habil. Elmar Peschke
Institut für Anatomie und Zellbiologie, Martin-Luther-Universität Halle-Wittenberg, Große Steinstraße 52, 06108 Halle,
Tel.: +49 345 557-1709, E-Mail: elmar.peschke@medizin.uni-halle.de
Arbeitstellenleiter: Dr. rer. nat. Eckhard Mühlbauer
Institut für Anatomie und Zellbiologie, Martin-Luther-Universität Halle-Wittenberg, Große Steinstraße 52, 06108 Halle,
Tel.: +49 345 557-1711, E-Mail: eckhard.muehlbauer@medizin.uni-halle.de
Mitarbeiter: Dr. rer. nat. Liudmila Litvak, Dr. rer. nat. Sabine Wolgast
Institut für Anatomie und Zellbiologie, Martin-Luther-Universität Halle-Wittenberg, Große Steinstraße 52, 06108 Halle,
Tel.: +49 345 557-1711, E-Mail: liudmila.litvak@medizin.uni-halle.de; sabine.wolgast@medizin.uni-halle.de
Anschrift der Arbeitsstelle: Institut für Anatomie und Zellbiologie, Martin-Luther-Universität
Halle-Wittenberg, Große Steinstraße 52, 06108 Halle/Saale
Tel.: +49 345 557-1709, -1711; Fax: +49 345 557-4053, E-Mail: elmar.peschke@medizin.uni-halle.de
Projektlaufzeit 15 Jahre (Januar 2000 bis Dezember 2014), Anzahl der Personalstellen: 2,5
Einleitung
Nach Prüfung und Genehmigung des Projektes durch die Union der Deutschen Akademien der Wissenschaften und die Bund-Länder-Kommission für Bildungsplanung und Forschungsförderung wurde im Januar 2000 das Forschungsvorhaben "Zeitstrukturen endokriner Systeme" begonnen. Nach Ausbau von Laboratorien und Einwerbung von Personal konnte noch im selben Jahr die Arbeit im Institut für Anatomie und Zellbiologie der Martin-Luther-Universität Halle-Wittenberg (Sitz der Projektgruppe) aufgenommen werden. Seitdem wurde das Thema auf Grund engagiert-kontinuierlicher Arbeit der Mitarbeiter und Dank hervorragender Begleitung des Projektes durch die Sächsische Akademie der Wissenschaften ohne Unterbrechung bearbeitet, was zu Erfolgen und Anerkennung, u.a. im Rahmen verschiedener externer Evaluierungen in den Jahren 2003, 2006 und 2009, geführt hat. Darüber hinaus wurden regelmäßig vor dem Präsidium der Sächsischen Akademie der Wissenschaften Ergebnisse und Ziele vorgestellt. Im Dezember 2014 endet die Projektarbeit planmäßig. Die Projektziele wurden erfüllt und zusätzlich entstandene Fragestellungen erfolgreich bearbeitet (Bilanz siehe Listung der Ergebnisse am Ende des Berichtes).
Arbeits- und Publikationsschwerpunkte
1. Die Insulinsekretion erfolgt im in vitro-Experiment circadian-rhythmisch
Erstmalig konnte unter Nutzung superfusionstechnischer Techniken [Peschke et al., 1997; Csernus et al., 1998] nachgewiesen werden, dass die Insulinsekretion der pankreatischen β-Zelle auch im in vitro-Versuch circadian-rhythmisch erfolgt [Peschke und Peschke, 1998]. Ferner wurde auf Grund umfangreicher Experimente deutlich, dass die Rhythmik in der pankreatischen Insel selbst generiert wird, wir es also mit einem peripheren Oszillator zu tun haben, der neben dem zentralen hypothalamischen Schrittmacher Nucleus suprachiasmaticus für die Rhythmik der Insulinsekretion pankreatischer Inseln bedeutungsvoll ist. Weiterführende Untersuchungen haben ergeben, dass in der Insel nicht nur Uhrengene wie Per1, Per2, Bmal1, Clock, Tim und Cry1 sowie das clock output-Gen Dbp exprimiert werden, sondern dass die genannten Genaktivitäten überwiegend circadian-rhythmisch oszillieren [Mühlbauer et al., 2004]. In Melatoninrezeptor MT1-, MT2- oder MT1/MT2-Rezeptor-„knockout“-Mäusen führte der funktionelle Verlust eines Rezeptors allein oder beider Rezeptoren gleichzeitig zu Phasenverschiebungen der Uhrengentranskripte von Per1 sowie der Uhrengen-gesteuerten Uhrengene Dbp und RevErbα, also Synchronisationsverlusten, bei erhaltener Rhythmik [Mühlbauer et al., 2009]. Untersuchungen an Kernrezeptoren mit Uhrenfunktion (Retinoic Acid-related Orphan-Rezeptoren, RORs) RORα, RORβ und RORγ, sowie des Faktors RXRα (Retinoid Rezeptor α) des Rattenpankreas konnten kürzlich belegen, dass diese ebenfalls in ihrer Expression einem circadianen Rhythmus unterliegen [Mühlbauer et al., 2012]. Zudem zeigte sich in der Insel ein differentielles Expressionsmuster, welches auf eine spezialisierte Funktion, vor allem von RORα, für die Glukagonsekretion aus den α-Zellen hindeutet, da RORα immunhistochemisch ausschließlich in diesem Zelltyp nachweisbar war. Weiter-führende Experimente sollten klären, ob genannte Uhrengene direkt oder auch indirekt, z.B. über Kaliumkanäle (Erg, Kir6.2/ Sur1), die circadian-rhythmische Insulinsekretion steuern [Mühlbauer et al., 2007]. Die Kenntnis dieses Sachverhaltes, eingeschlossen die daraus folgende Möglichkeit, Einfluss auf die Insulinsekretion zu nehmen, könnte künftig klinische Bedeutung erlangen, da Rhythmusstörungen und Desynchronisationen von Krankheitswert sind.
2. Die pankreatische β-Zelle verfügt über zwei Melatonin-Rezeptor-Isoformen
Zunächst konnte von der Arbeitsgruppe nur der Melatoninrezeptor MT1 nachgewiesen werden [Peschke et al., 2000, 2002]. Später gelang unter Nutzung eines veränderten Primer-Designs auch der Nachweis des MT2-Reptors auf der pankreatischen β-Zelle [Mühlbauer und Peschke, 2007; Peschke et al., 2007; Peschke, 2008]. Die Nachweise wurden inzwischen an Ratten-Insulinomazellen INS1, isolierten Ratten-Inseln als auch Pankreasgewebe von Ratte und Mensch validiert. Die Rezeptorergebnisse und ihre Veröffentlichung wurden 2009 unter Zitation unserer Erstbeschreibung in verschiedenen „Nature genetics“-Publikationen berücksichtigt [u.a. Prokopenko et al.: Variants in MTNR1B influence fasting glucose levels, Nat. Genet. 2009, 41: 77–81; Bouatia-Naji et al.: A variant near MTNR1B is associated with increased fasting plasma glucose levels and type 2 diabetes risk, Nat. Genet. 2009, 41: 89–94; Lyssenko et al.: Common variant in MTNR1B associated with increased risk of type 2 diabetes and impaired early insulin secretion, Nat. Genet. 2009, 41:82-88].
3. Gentechnische Melatoninrezeptor-Untersuchungen an INS1-β-Zellen
Das Indolamin Melatonin übt, wie oben beschrieben, seine zellulären Wirkungen über zwei membranständige Rezeptor-Isoformen, nämlich den MT1 (Mel1a) und den MT2 (Mel1b) aus, wobei die Kenntnisse über die Melatonin-vermittelten Effekte dieser Rezeptoren in der pankreatischen β-Zelle und die jeweilige Bedeutung für das Signalgeschehen und die Insulinsekretion noch lückenhaft sind. Um näheres über die Bedeutung des MT2-Rezeptors für die β-Zelle und die an diese Isoform geknüpften Signalkaskaden zu erfahren, wurde als Zellmodell die Ratten-insulinoma-Zelllinie INS1 genutzt. Es gelang mittels gentechnischer Methoden in dieser Glukose-responsiven β-Zelllinie, nach Einschleusung, den humanen MT2 (hMT2) Rezeptor stabil zu exprimieren [Mühlbauer et al., 2011]. Einige genetische Varianten dieser Rezeptor-Isoform waren kurz zuvor durch mehrere internationale Assoziationsstudien mit Typ2-Diabetes in Verbindung gebracht worden (siehe oben). Melatonin senkte in Zellen mit hMT2-Expression die Insulinsekretion stärker als in der genetisch unveränderten Ausgangslinie, was als Indiz für eine funktionelle Kopplung des hMT2 Rezeptors an inhibitorische GTP-bindende Proteine (Gi-Proteine) gewertet werden kann. Die Analytik der mit dem Rezeptortyp MT2 verknüpften Signalkaskaden zeigte zum einen, dass Melatonin über hMT2-Rezeptoren hemmend auf den „second messenger“ cyclisches Adenosinmonophosphat (cAMP) wirkt, zum anderen aber auch gleichzeitig, wenn auch in geringerem Ausmaß, auf cGMP. Die Aktivierung beider Kaskaden über Gi-Proteine führte insgesamt zu einer Verminderung der Insulinsekretion. Die Bedeutung von Gi-Proteinen für die Hemmung der Insulinsekretion konnte durch Präinkubation der INS1-Zellen mit dem Gi-Protein-Blocker Pertussistoxin nachgewiesen werden.
Um darüber hinaus weitere Informationen zur Funktionsbedeutung der Rezeptor-Isoformen in der INS1-Zelle (als Modell einer nativen β-Zelle) zu erlangen, wurde im Zuge eines zweiten Projektes durch RNA-Interferenz (RNAi) die Expression des MT1-Rezeptors auf Transkriptebene supprimiert [Mühlbauer et al., 2012]. Zellen einer dergestalt gentechnisch modifizierten, klonalen INS1-Linie wiesen phänotypisch einen stark gesenkten Besatz mit MT1-Rezeptoren auf. Funktionelle Experimente mit Melatonin bei diesen Zellen mit MT1-„knockdown“ belegten, dass über den MT1-, nicht aber über den MT2-Rezeptor, die entscheidende Hemmung der Insulinsekretion vermittelt wird. Zudem konnte der Nachweis erbracht werden, dass der MT1-Rezeptor der β-Zelle mit der cAMP-Kaskade über Hemmung der Phosphorylierung des Transkriptionsfaktors CREB, nicht aber mit cGMP, verknüpft ist. Dieser Befund konnte an isolierten Inseln von Mauslinien mit funktioneller Deletion („knockout“) des MT1, des MT2 oder beider Rezeptoren gleichzeitig, erhärtet werden. Inseln mit einem „knockout“ des MT1 oder „knockout“ beider Isoformen gleichzeitig, nicht aber solche des Wildtyps oder solche mit „knockout“ der MT2 Isoform, vermochten die inhibierende Melatoninwirkung aufzuheben. Daraus lässt sich folgern, dass die hemmenden Melatonineffekte auf die Insulinsekretion primär über MT1-Rezeptoren vermittelt werden. Im Zuge der geschilderten Untersuchungen konnte ferner belegt werden, dass unter speziellen Voraussetzungen, nämlich nach längerer (6-stündiger) Prä-Inkubation mit Melatonin, dieses Hormon auch stimulierende Effekte auf die Insulinsekretion entwickeln kann. Vergleichbare Effekt sind von Untersuchungen anderer Zelltypen bekannt und wurden als "Sensitivierungseffekt des Rezeptors" erklärt. In Ergänzung zu den genannten Befunden konnte zuletzt gezeigt werden, dass Melatonin zeitabhängig in INS1 Zellen einen hemmenden Einfluss auf den Forskolin- oder IBMX-stimulierten Phosphorylierungsgrad des Transkriptionsfaktors „cAMP-response-element binding protein“ (CREB) hat, ein Effekt der sich auch auf die Expression der Calcium-Calmodulin-abhängigen Kinase CamK2d auswirkt [Bazwinsky-Wutschke et al., 2012]. Diese Kinase beeinflusst unter anderem die Expression des Insulingens. Damit erstreckt sich die inhibitorische Wirkung von Melatonin auch auf die genetische Ebene mit der Konsequenz einer modulatorischen Wirkung auf eine Vielzahl von Genen, die, wie die inselspezifische Camk2d, ein cAMP-response-element (CRE) im Promotorbereich aufweisen.
4. Der Rezeptor-mediierte Einfluss von Melatonin auf die Insulinsekretion erfolgt in der pankreatischen β-Zelle unter Nutzung unterschiedlicher Signalwege
Im Ergebnis der eigenen Untersuchungen konnte der Einfluss von Melatonin auf die pankreatische β-Zelle und damit auf die Insulinsekretion im Rahmen der Projektarbeit aufgeklärt werden. Dazu kann festgestellt werden, dass auf Grund superfusionstechnischer, molekularbiologischer, konfokal- und elektronenmikroskopischer sowie immunhistochemischer und radioimmunologischer Ergebnisse nachgewiesen werden konnte, dass Melatonin in der pankreatischen β-Zelle (Modell: Ratten-Insulinoma-Zelllinie INS1) über die cAMP- sowie cGMP-Signalkaskade die Insulinsekretion hemmt, auf dem Weg der IP3-Kaskade die Insulinsekretion jedoch steigert [Übersichten: Peschke, 2008; Peschke und Mühlbauer, 2010; Bach und Peschke, 2012].
Beide Effekte werden über MT1- und MT2-Rezeptoren vermittelt (funktionelle, autoradiographische, immunologische und molekularbiologische Nachweise). Unter dem Einfluss der kompetitiven Melatoninrezeptor-Blocker Luzindol und 4P-PDOT werden die Wirkungen von Melatonin nahezu aufgehoben. Forskolin stimuliert dosisabhängig die Insulinsekretion von INS1-Zellen über eine intrazelluläre cAMP-Freisetzung, die durch gleichzeitige Melatonin-Gabe reduziert wird. Die hemmende Melatoninwirkung auf die cAMP-Signalkaskade ist mit dem Gi-Protein-Inhibitor Pertussistoxin (PTX) aufhebbar. Offenbar ist sowohl der cAMP- als auch der cGMP-senkende – und folglich die Insulinsekretion hemmende - Einfluss von Melatonin stärker als der IP3-liberierende - die Insulinsekretion steigernde - Einfluss. Erst unter Blockierung der cAMP-Signalkaskade mit PTX (Gi-Protein-Blockierung) zeigt sich ein stimulierender Einfluss von Melatonin auf die IP3-Signalkaskade. Die gleichzeitige Nutzung antagonistischer Signalkaskaden durch Melatonin ist nicht ungewöhnlich. Bei der Einordnung in den physiologischen Kontext ist der Zeitfaktor bedeutungsvoll. Die volle Ausprägung der cAMP-inhibierenden Wirkung von Melatonin verlangt eine Präinkubation, während die IP3-stimulierende Wirkung sofort eintritt. Melatonin wird an der pankreatischen β-Zelle unter anderem eine Funktion als circadianer Synchronisator zuerkannt. Charakterisierung der 3 Signalwege, die Melatonin zur Beeinflussung der Insulinsekretion nutzt:
- Signalweg: Melatonin – MT-Rezeptoren – Gi-Proteine – Adenylatzyklase – cAMP – CREB [Peschke et al., 2000, 2002; Mühlbauer et al., 2012; Bazwinsky-Wutschke et al., 2012]
- Signalweg: Melatonin – MT-Rezeptoren – Gi-Proteine – Guanylatzyklase – cGMP [Stumpf et al., 2008, 2009, Mühlbauer et al., 2011]
- Signalweg: Melatonin – MT-Rezeptoren – Gq-Proteine – Phospholipase C – IP3 [Bach et al., 2005; Peschke et al., 2006]
5. Melatonin ist in pharmakologischen Dosen ein exzellenter Radikal-Scavenger
Weiterhin können wesentliche Untersuchungsergebnisse zur Radikal-Scavenger-Bedeutung von Melatonin mitgeteilt werden. In verschiedenen in vitro-Studien konnte gezeigt werden, dass Melatonin, gemeinsam appliziert mit dem chemischen Diabetogen Alloxan (ALX), β-Zell-Nekrosen verhindert und damit das Auftreten eines Typ1-Insulinmangeldiabetes hemmen kann. Davon ist abzuleiten, dass ALX in Gegenwart intrazellulärer Reduktionsmittel, wie z.B. Glutathion (GSH), reaktive Sauerstoffverbindungen (ROS) bildet und diese eine wesentliche Ursache für die Zytotoxizität von ALX darstellen. Es wurde gefolgert, dass ein Teil der beobachteten Zytoprotektion von Melatonin auf seine Fähigkeit, ROS zu neutralisieren, zurückzuführen ist. Im direkten Vergleich mit anderen zellulären sowie auch biosynthetisch hergestellten Antioxidantien erwies sich Melatonin als besonders effizient bei der Detoxifikation von Hydroxylradikalen (·OH), die als stärkstes zellschädigendes Agens der ROS-Familie angesehen werden [Brömme et al., 1999, 2000, 2001, 2002, 2005; Ebelt et al., 2000; Peschke et al., 2000]. Da ROS, und insbesondere OH, auf Grund ihrer extrem hohen Reaktivität mit nahezu jeder zellulären Verbindung interagieren können, müssten effektiv wirkende Antioxidantien in sehr hoher Konzentration am Ort der potentiellen ROS-Bildung vorliegen, um erfolgreich wichtige zelluläre Targets wie Nukleinsäuren, Proteine und Lipide vor einer ROS-Attacke zu schützen. Ausgehend von den physiologischen Konzentrationen von Melatonin, GSH und anderen zellulären Antioxidantien sowie von der kalkulierbaren transienten ROS-Bildung nach Gabe diabetogener ALX-Konzentrationen, sollte die Bedeutung von Melatonin für den Schutz vor ROS umfassend evaluiert werden.
6. Untersuchungen zum Einfluss von Melatonin auf die Insulinsekretion der pankreatischen β-Zelle, Insulin-Melatonin-Antagonismen bei Typ1- und Typ2-Diabetes
Schließlich können erste klinische Befunde mitgeteilt werden, die in jüngerer Zeit die Arbeit der Projektgruppe nachhaltig bestimmt haben. Zurückblickend fällt auf, dass die Diskussion um veränderte Melatonin-Plasmaspiegel im Zusammenhang mit diabetischer Stoff-wechselentgleisung über Jahrzehnte kontrovers geführt wurde. Wir konnten bei Untersuchungen im Tagesverlauf nachweisen, dass – im Vergleich zu metabolisch gesunden Individuen – Typ2-diabetische Erwachsene ebenso wie Typ2-diabetische Goto-Kakizaki(GK)-Ratten durch verringerte Melatonin-Plasmaspiegel auffällig werden [Peschke et al., 2006, 2007; Frese et al., 2007, Peschke, 2008]. Zur Bestimmung der Melatonin-Plasmaspiegel wurden 6 Wochen alte GK- und Wistar-Ratten in 3h-Intervallen unter definierten Beleuchtungsverhältnissen (L:D = 12:12, Licht an: 7.00 Uhr) getötet. Mittels real-time RT-PCR wurden die tagesrhythmische Expression der MT1-Rezeptor-mRNA im Pankreas, der Arylalkylamin-N-acetyltransferase (AANAT)-mRNA (Schlüsselenzym der Melatoninsynthese) und der Insulin-Rezeptor(InsR)-mRNA im Pinealorgan untersucht. Zusätzlich wurde die pineale AANAT-Aktivität im Tagesverlauf mit einem 14C-Assay bestimmt. Die AANAT-Aktivität ist bei GK-Ratten vermindert. Ferner gelang es erstmalig, die Expression von InsR-mRNA im Pinealorgan nachzuweisen. Die AANAT-mRNA wird bei erhaltenem Tagesrhythmus vermehrt exprimiert, ebenso wie die Expression der MT1-Rezeptor-mRNA im Pankreas der GK-Ratte erhöht ist. GK- und Wistar-Ratten erreichen das Maximum der Expression von AANAT-mRNA sowie MT1-Rezeptor-mRNA in der Mitte der Dunkelzeit.
Um nachweisen zu können, an welcher Stelle der Melatoninsynthese bei Typ2-diabetischen Tieren der Schaden gesetzt wird, wurden bei 8 und 50 Wochen alten Wistar- und GK-Ratten neben Melatonin auch seine Vorstufen (Tryptophan, 5-hydroxytryptophan, Serotonin und N-acetylserotonin) Mitte der Licht- und Dunkelzeit HPLC-technisch quantifiziert. Zusätzlich wurden die Melatonin-synthetisierenden Enzyme, der pineale Noradrenalin-Gehalt und der pineale Proteingehalt bestimmt. Es zeigte sich, dass die Epiphysen Typ2-diabetischer Ratten charakteristische Abweichungen aufweisen, die folgendermaßen zusammengefasst werden können: (1.) veränderte Aktivitäten der Melatonin-synthetisierenden Enzyme, (2.) Verringerung der Vorstufen der Melatoninsynthese und (3.) verringerte Noradrenalinspiegel während der Nacht, was die erniedrigte Melatonin-Synthese erklären würde (Frese et al., 2009). In der Folgezeit konnten diese Ergebnisse durch Gewinnung von Tagesprofilen erweitert und validiert werden [Bach et al., 2010]. In einem weiteren Versuch wurden hohe Mengen von Melatonin normoglykämischen Wistar- und Typ2-diabetischen GK-Ratten oral verabreicht („Trinkmodell“). Im Ergebnis ließ sich in Ergänzung zu früher durchgeführten in vitro-Superfusionsexperimenten nachweisen, dass auch im Tierversuch Melatonin die Insulinkonzentration im Blut senkt. Durch diesen Versuch konnten somit die bisherigen in vitro-Befunde untermauert werden [Peschke et al., 2010].
Von Bedeutung waren zusätzlich Untersuchungen an Typ1-diabetischen Ratten, die bei stark erniedrigtem oder fehlendem Insulin erhöhte Melatonin-Plasmaspiegel aufwiesen, also in Umkehrung wiederum einen Insulin-Melatonin-Antagonismus zeigten [Peschke et al. 2008, 2011, 2012, Abb. 1]. In überzeugender Weise konnte weiterhin gezeigt werden, dass nach Insulinsubstitution sich nicht nur die Insulin-, sondern ebenfalls die Melatonin-Spiegel normalisierten. Diese und weitere Befunde haben in Einheit mit umfangreichen Katecholamin-Bestimmungen zu der Überzeugung geführt, dass die Katecholamine für das beschriebene antagonistische Verhalten von Insulin und Melatonin verantwortlich zu machen sind [Übersicht siehe Peschke et al., 2012]. Zusammenfassend kann festgestellt werden, dass Typ 2-Diabetiker erniedrigte Katecholamin- und Melatonin-Spiegel, Typ 1-Diabetiker hingegen erhöhte Katecholamin- und Melatonin-Spiegel aufweisen. Als Erklärung wird angenommen, dass die Katecholamin-Spiegel den Schlüssel für das Verständnis der Gegensinnigkeit darstellen, weil die Melatoninsynthese durch Katecholamine entscheidend gesteigert wird (Abb. 1).
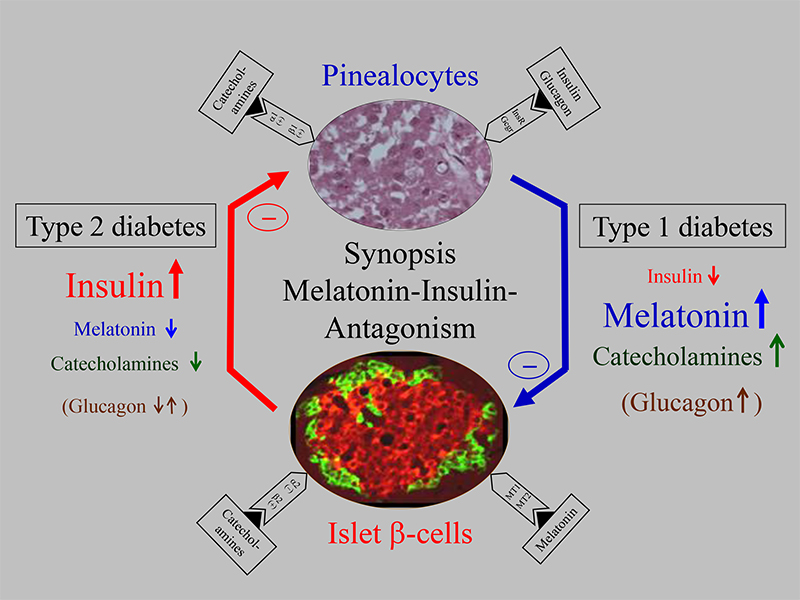
Figure 1: Synoptic presentation of the insulin–melatonin antagonism in relation to the importance of melatonin for type 1 and type 2 diabetes, including interactions with glucagon and catecholamines. At a relatively early stage of type 2 diabetes (left side), insulin secretion is increased, while melatonin synthesis is decreased. These reactions have been observed in type 2 diabetic Goto Kakizaki (GK) rats and humans. Whereas glucagon secretion in an early stage of type 2 diabetes is decreased, after full development of the disease it is increased (comparable to type 1 diabetes; for more information see Bähr et al. in the same volume). In contrast to type 2 diabetes, under type 1 diabetic conditions (right side), insulin was greatly reduced and, subsequently, melatonin was significantly increased. These reactions have been observed in streptozotocin (STZ)-treated Wistar rats, as well as in LEW.1AR1-iddm rats, a spontaneous animal model of human type 1 diabetes mellitus. Thus, the influence of insulin on the pinealocytes is mediated by insulin receptors in the pineal gland (upper area), and the influence of melatonin on the pancreatic β-cells is mediated by the MT1 and MT2 melatonin receptors (lower area). Much more conclusive, however, is the well-known insulin–catecholamine relationship, which may be a key to understanding the insulin–melatonin antagonism. The increase of catecholamines stimulates adrenoceptor β1 and, consequently, the cAMP cascade, while adrenoceptor α1 activates the IP3 cascade in the pineal gland; together they stimulate melatonin synthesis and secretion (upper area). Catecholamines (in contrast to acetylcholine), on the other hand, have an inhibitory effect on insulin secretion (lower area). To support this, the GK rat model of type 2 diabetes shows diminished plasma catecholamines (left side), whereas the rat models of type 1 diabetes (STZ and LEW.1AR1-iddm) exhibit increased catecholamines (right side). This supports the conviction that type 1 diabetes is associated with stress and enhanced melatonin secretion. An explanation of the increased melatonin levels in type 1 diabetic STZ and also possibly LEW.1AR1-iddm rats could be that melatonin protects the organism by attenuating the oxidative stress–induced β-cell damage in type 1 diabetes.
7. Untersuchungen zum Einfluss von Melatonin auf die Glukagonsekretion der pankreatischen α-Zelle
Neben den beschriebenen β-Zell- und Insulin-Untersuchungen haben molekularbiologische und zellphysiologische Versuche den Nachweis erbracht, dass auch Glukagon-produzierende pankreatische α-Zellen (α-Zelllinie αTC1.9) Melatoninrezeptoren (MT1 und MT2) exprimieren [Bähr et al., 2011]. Durch die Melatoninrezeptor-Expression sowie ihre Glukose- und Insulin-Responsivität stellte die Glukagon-produzierende αTC1.9-Zelllinie ein geeignetes Zellmodell für Analysen zur Melatoninwirkung auf die Glukagonsekretion dar. Die Ergebnisse von Inkubationsexperimenten mit αTC1.9-Zellen zeigten erstmals, dass Melatonin sowohl die Expression als auch die Sekretion von Glukagon signifikant erhöht [Bähr et al., 2011]. Durch Vorinkubation mit Melatoninrezeptor-Antagonisten wurde die Glukagon-erhöhende Wirkung von Melatonin aufgehoben. Damit konnte nachgewiesen werden, dass es sich um einen Rezeptor-spezifischen Effekt handelt. Zusätzlich wurden Untersuchungen zur Beteiligung spezifischer Signalkaskaden durchgeführt: Eine Ko-Inkubation mit Pertussistoxin bewirkte keine Aufhebung des Glukagon-steigernden Melatonineffektes. Zudem kam es durch Melatonininkubation zu keiner Änderung der cAMP-Konzentration in den αTC1.9-Zellen. Somit konnte eine Beteiligung Gαi- und Gαs-gekoppelter Proteine ausgeschlossen werden. Demgegenüber bewirkten Blockierung der Phosphatidylinositol-3-kinase (PI3K) sowie der Einsatz eines Phospholipase C-Inhibitors eine Hemmung der Melatoninwirkung bei αTC1.9-Zellen [Bähr et al., 2012]. Dies führte zu der Einsicht, dass Melatonin seine Effekte in der pankreatischen α-Zelle über Gαq-gekoppelte sowie PI3K-abhängige Signalwege vermittelt. Ferner wurden Untersuchungen an isolierten Langerhansschen Inseln verschiedener Tiermodelle durchgeführt. Sowohl in Inseln stoffwechselgesunder als auch Typ2-diabetischer Ratten erhöhte Melatonin die Glukagonsekretion statistisch signifikant. Ebenso wurde bei Inkubationsversuchen an Inseln von Melatoninrezeptor-knockout-Mäusen gegenüber Wildtyp-Mäusen eine signifikant verminderte Glukagonsekretion nachgewiesen. Damit konnte gezeigt werden, dass Melatonin auch im Zellverband des endokrinen Pankreas die Glukagonfreisetzung Rezeptor-vermittelt erhöht [Bähr et al., 2012].
Durch Studien an Melatonin-behandelten Ratten und Melatoninrezeptor-knockout-Mäusen konnte die Wirkung des Indolamines auf die Glukagonsekretion auch in vivo bestätigt werden, da Melatonin-substituierte stoffwechselgesunde Ratten gegenüber der Kontrollgruppe signifikant erhöhte Plasma-Glukagonkonzentrationen aufwiesen. Bei Typ2-diabetischen Tieren war das Plasma-Glukagon gegenüber dem stoffwechselgesunder Kontrolltiere signifikant erhöht. Melatoninsubstitution führte bei Typ2-diabetischen Ratten jedoch zu einer leichten Erniedrigung der Plasma-Glukagonkonzentration. Zudem wurde nachgewiesen, dass die hepatische Glukagonrezeptor-Expression nach Melatoninsubstitution bei stoffwechselgesunden Ratten signifikant erhöht und bei Typ2-diabetischen Ratten erniedrigt war – möglicherweise eine kompensatorische Regulierung der veränderten Glukagon-Plasmaspiegel [Bähr et al., 2011]. Schließlich konnte nachgewiesen werden, dass die Glukagonkonzentration im Plasma von Melatoninrezeptor-knockout-Mäusen im Vergleich zu Kontrolltieren signifikant erniedrigt und die Expression des Glukagonrezeptors in der Leber bei Mäusen mit Melatoninrezeptor-knockout signifikant erhöht waren [Bähr et al., 2012]. Zusammenfassend kann festgestellt werden, dass Melatonin die Glukagonsekretion Rezeptor-abhängig steigert und Einfluss auf die periphere Wirkung von Glukagon nimmt. Die αTC1.9-Zelllinie, sowie die pankreatische Insel und b-Zellen exprimieren zudem, wie erstmalig gezeigt, den Glukosetransporter GLUT4 (Bähr et al., 2012b).
8. Untersuchungen zum Einfluss von Melatonin auf die Somatostatinsekretion der pankreatischen δ-Zelle
Pankreatische, das Hormon Somatostatin produzierende δ-Zellen machen etwa 4 bis 5% aller endokrinen Zellen humaner pankreatischer Inseln aus und stellen damit neben Glukagon-produzierenden α-Zellen und Insulin-produzierenden β-Zellen die kleinste Fraktion dar. In der Insel hat Somatostatin eine regulatorische Funktion indem es parakrin sowohl auf α- als auch auf ß-Zellen sekretionshemmend wirkt.
Bei unseren Untersuchungen wurde die humane pankreatische δ-Zelllinie QGP-1 als Modell eingesetzt, um Einflüsse von Melatonin auf die Hormonsekretion zu studieren. Zunächst wurde durch RT-PCR als auch durch Immunhistochemie verifiziert, dass beide Isoformen des membranständigen Melatoninrezeptors MT1 und MT2 in dieser Zelllinie exprimiert werden, eine Voraussetzung für nachfolgende Arbeiten zur Rezeptorfunktion (Zibolka et al., 2014, Publikation submitted bei J. Pineal Research). Die Einwirkung von Melatonin in steigenden Konzentrationen zwischen 100 pmol/l und 10 µmol/l wurde über 4 Stunden auf das Sekretionsverhalten von QGP-1-Zellen in „Batch-Kultur“ ermittelt. Dabei zeigte sich nach Auswertung über einen spezifischen Radioimmunoassay (RIA) eine dichotome Dosis-Wirkungsbeziehung. Während im Bereich physiologischer Melatoninkonzentrationen (zwischen 100 pmol/l und 1nmol/l) eine statistisch signifikante Hemmung der Somatostatin-Ausschüttung zu verzeichnen war, verschwand dieser hemmende Effekt bei steigenden Konzentrationen, und bei 10 µmol/l Melatonin ließ sich sogar eine leichte, nicht-signifikante Sekretionssteigerung beobachten. Es spricht viel dafür, dass die Hemmung der Hormonausschüttung durch Kopplung von membranständigen Melatoninrezeptoren (analog zur Situation in β-Zellen) an cAMP- sowie cGMP-modulierende, inhibitorische G-Proteine (Gi) verursacht wird. Bei pharmakologischen Konzentrationen von Melatonin könnten Desensitisierungsprozesse (Entkopplung des Rezeptors von der cAMP-Kaskade) sowie Internalisierungsvorgänge des Rezeptors eine Rolle spielen, die in der Endkonsequenz die Melatonin-verursachte Hemmung wieder aufheben. Die Bedeutung, zumindest des MT1-Rezeptors, konnte durch Inkubationsexperimente mit dem nichtselektiven Rezeptorantagonisten Luzindol belegt werden. Der Einsatz von 100 nmol/l Luzindol hob die hemmende Wirkung von 1 nmol/l Melatonin komplett auf, nicht aber der Einsatz des MT2-selektiven 4-P-PDOT. Auf der Ebene des second messengers cAMP bewirkten Inkubationen mit steigenden Melatoninkonzentrationen eine ausschließliche Senkung der cAMP-Konzentration, die bei cGMP hingegen eine deutliche Dosisabhängigkeit erkennen ließ (Messungen durch das immunologische Verfahren spezifischer Enzymimmunoassays). Ein hemmender Effekt von 1 nmol/l Melatonin ließ sich am besten bei niedrigen Glukosekonzentrationen (zwischen 1 und 5 mmol/l) erfassen, war aber auch bis 20 mmol/l nachweisbar (allerdings ohne die Signifikanzgrenze zu erreichen). Interessanterweise ließen sich die obengenannten Effekte an den δ-Zellen nachweisen, ohne dass das second messenger-System der Zelle durch Adenylatzyklase-Stimulatoren (Forskolin) oder Phosphodiesterase-hemmer wie IBMX beeinflusst werden mussten. Das spricht für eine hohe Ansprechbarkeit des verwendeten Zellmodells auf physiologische Konzentrationen von Melatonin und könnte darüber hinaus charakteristisch für native δ-Zellen sein.
Mittels der gentechnischen Methode der Zell-Transfektion wurden Vektor-Konstrukte, gekoppelt an den starken Cytomegalovirus early (CMV)-Promoter, die zum einen die cDNA des MT1, zum anderen die des MT2 trugen, in QGP-1-Zellen transient zur Überexpression gebracht (also ohne genomische Verankerung der eingeführten DNA). Die Überexpression der beiden Rezeptoren konnte nach 48 Stunden durch RT-PCR verifiziert werden. Physiologische Experimente solchermaßen genetisch manipulierter Zellen mit unterschiedlichen Melatoninkonzentrationen (1 nmol/l, 100 nmol/l und 10 µmol/l) zeigten, dass die hemmende Wirkung auf Somatostatin im Wesentlichen MT1-Rezeptor mediiert wird. QGP-1 Zellen mit nachweisbarer Überexpression des MT2-Rezeptors verhielten sich analog zu Kontrollzellen, die mit einem neutralen Genkonstrukt transfiziert worden waren, d.h. 1 nmol/l Melatonin führte zu statistisch signifikanter Hemmung der Somatostatinsekretion, wohingegen pharmakologische Dosen zur Aufhebung der Hemmung bis hin zu einer leichten Sekretionssteigerung führten (10 µmol/l). Im Gegensatz dazu führten alle drei verwendeten Melatoninkonzentrationen bei Überexpression des MT1-Rezeptors zu einer signifikanten Sekretionshemmung.
Zusammenfassend zeigt sich, dass Melatonin unter physiologischen Bedingungen am humanen δ-Zellmodell QGP-1 eine Somatostatin-Sekretionshemmung hervorruft, die über Gi-Proteine und cAMP vermittelt wird. Wie sich die drei untereinander hormonell beeinflussenden Inselzelltypen β, α und δ in vivo unter Melatonineinfluss verhalten, bleibt weiteren Untersuchungen an der Insel vorbehalten. Es sollte jedoch stets berücksichtigt werden, dass das „Hormon der Dunkelheit“, Melatonin, hauptsächlich nachts wirkt, so dass Unterschiede in Bedeutung und steuernder Funktion zwischen nachtaktiven Tieren (z.B. Nagern) und tagaktiven Lebewesen (Mensch, Kaninchen) zu erwarten sind.
9. Ausblick
Abschließend sei festgestellt, dass die bisherigen Ergebnisse eine sehr erfolgversprechende Grundlage für bereits begonnene und weiterführende Untersuchungen darstellen. Dazu gehört die Klärung der Frage, ob und in welcher Weise Uhrengene die circadian-rhythmische Insulinsekretion steuern. Die Kenntnis dieses Sachverhaltes, eingeschlossen die Möglichkeit, Einfluss auf die Insulinsekretion zu nehmen, wäre von erheblicher klinischer Bedeutung. Ferner sollte nach erfolgter intensiver Untersuchung von Melatonin-Rezeptoren auf den pankreatischen α-, β- sowie δ-Zellen analysiert werden, wie das komplexe Zusammenspiel oder Konzert der verschiedenen Melatonin-sensitiven α, β und δ-Zellen anhand von Zellmodellen und in vivo-Untersuchungen unter dem Einfluss von Melatonin erklärt werden kann. Neben der als gesichert geltenden Rolle von Melatonin als Rhythmus-synchronisierendes Hormon kann auch eine direktere physiologische Rolle von Melatonin auf das Sekretionsgeschehen der Inselzellen nicht ausgeschlossen werden. Zusätzlich sollte in Kenntnis der Lipophilie von Melatonin stärker als bisher der Einfluss von Melatonin auf zytosolische und Kernrezeptoren in die Untersuchungen mit einbezogen werden. Die Bedeutung von Melatonin wird ferner vor dem Hintergrund der obengenannten Gen-Varianten des MT2-Rezeptors perspektivisch an Bedeutung zunehmen und konsekutiv stärker als bisher klinisches Interesse erlangen. Schließlich stellen die unter Punkt 5 aufgeführten Fragen eine Herausforderung dar, nämlich, ob unter physiologischen Bedingungen Melatonin tatsächlich als Radikal-Scavenger wirkt, oder wie wir haben feststellen müssen, nur unter supraphysiologischen, pharmakologisch hohen Dosen Radikale neutralisiert.
Listung der Ergebnisse
Während der gesamten Laufzeit des Projektes wurde in den Jahrbüchern der Akademie über Ergebnisse, Planungen und den Fortgang der Arbeit insgesamt berichtet sowie ein Projekt-begleitender Kolloquien-Zyklus ins Leben gerufen (inzwischen mehr als 50 Veranstaltungen mit Gästen aus Frankreich, Österreich, Schweden, der Schweiz, Ungarn, den USA und der Bundesrepublik Deutschland). Ein erheblicher Anteil der Vorträge wurde in Form von Übersichtsartikeln in 5 Abhandlungsbänden der Akademie veröffentlicht (Endokrinologie I bis V; 2003, 2005, 2007, 2009 und 2014 erschienen). 2010 wurde unter der Schirmherrschaft der Leopoldina ein Symposium "Chronobiologie" von der Arbeitsgruppe organisiert und die Beiträge in einem Band zusammengefasst [Nova Acta Leopoldina, NF, Band 114, Nummer 389]. Darüber hinaus wurde das Projekt durch die Universität Halle in dankenswerter Weise unterstützt, wodurch die Erfolge möglich und die gewollte Kooperation zwischen Akademie und Universität befördert wurden. 2013 erfolgte ein weiteres Symposium in der Sächsischen Akademie der Wissenschaften mit dem Thema „Melatonin und Diabetes mellitus“. Die Tagungsbeiträge wurden im Abhandlungsband Endokrinologie V zusammengefasst. Ferner wurden vom Projektleiter 4 Plenarvorträge (darunter 2 öffentliche Vorträge) gehalten und Teilergebnisse in 2 Sitzungsberichten der Akademie herausgegeben. Ferner hat die Akademiegruppe während ihrer 15-jährigen Projektlaufzeit von 2000 bis 2014 mehr als 100 Originalarbeiten publiziert und die Ergebnisse durch ebenso viel Vorträge und Posterbeiträge auf Tagungen mitgeteilt. Schließlich wurden im Rahmen der Projektarbeit 12 Promotionen und eine Habilitation erfolgreich abgeschlossen. Sechs Promotionsverfahren konnten mit „summa cum laude“ abgeschlossen werden, zwei Dissertationen wurden mit Förderpreisen der Sächsischen Akademie ausgezeichnet. Die Arbeitsgruppe erfreut sich international anerkannter wissenschaftliche Reputation. Die Publikationen der Projektgruppe werden weltweit in einschlägigen Schriften zitiert.
Literaturangaben: Siehe Publikationen
Aktualisiert: Oktober 2014, verantwortlich: E. Peschke
Projektgruppe
- Elmar Peschke, Prof. Dr. med. habil. [Projektleiter, OM, Mathematisch-naturwissenschaftliche Klasse]
